Hoe Bepaal Je Het Aantal Elektronen In Een Atoom?
How To Find The Protons Neutrons And Electrons Of An Element On The Periodic Table
Keywords searched by users: hoe weet je hoeveel elektronen een atoom heeft hoe weet je hoeveel neutronen er in een atoom zitten, hoe bereken je neutronen, hoe bereken je het massagetal van een atoom, hoeveel elektronen per schil, hoe bereken je het aantal elektronen, aantal elektronen berekenen met lading, hoe weet je hoeveel valentie-elektronen een atoom heeft, aantal neutronen zuurstof
Wat zijn elektronen en hun rol in atomen?
Elektronen zijn subatomaire deeltjes die een negatieve lading dragen. Ze bewegen rond de kern van een atoom en zijn essentieel voor de chemische eigenschappen van elementen. Elektronen zijn betrokken bij chemische reacties en bepalen het gedrag van atomen bij het vormen van bindingen met andere atomen.
In een atoom zijn elektronen georganiseerd in verschillende energieniveaus, ook wel schillen genoemd. Het binnenste energieniveau heeft de laagste energie en kan het kleinst aantal elektronen bevatten, terwijl de buitenste schil, ook wel de valentieschil genoemd, het grootst aantal elektronen kan bevatten.
Elektronen spelen een cruciale rol bij het stabiliseren van atomen. Een atoom streeft ernaar om een volledige valentieschil te hebben, wat meestal betekent dat het 8 elektronen bevat (behalve waterstof en helium, die stabiel zijn met respectievelijk 2 en 2 elektronen in hun buitenste schil). Dit wordt de octetregel genoemd. Atomen proberen elektronen te winnen, te verliezen of te delen om een stabiele elektronenconfiguratie te bereiken.
Hoe worden elektronen geconfigureerd in een atoom?
Elektronenconfiguratie verwijst naar de manier waarop elektronen in een atoom zijn gerangschikt volgens hun energieniveaus en schillen. De elektronenconfiguratie van een atoom wordt bepaald door de opbouwregel, die stelt dat elektronen zich vullen in de laagste energieorbitalen voordat ze naar hogere energieorbitalen gaan.
De elektronenconfiguratie wordt geschreven met behulp van de volgende notatie: het energieniveau (aangeduid met het hoofdkwantumgetal) gevolgd door de letter van de schil, en het aantal elektronen in die schil tussen haakjes. Bijvoorbeeld, de elektronenconfiguratie van zuurstof (O) is 1s2 2s2 2p4, wat betekent dat er 2 elektronen zijn in de 1s-schil, 2 elektronen in de 2s-schil en 4 elektronen in de 2p-schil.
Hoe weet je het aantal elektronen in de buitenste schil van een atoom?
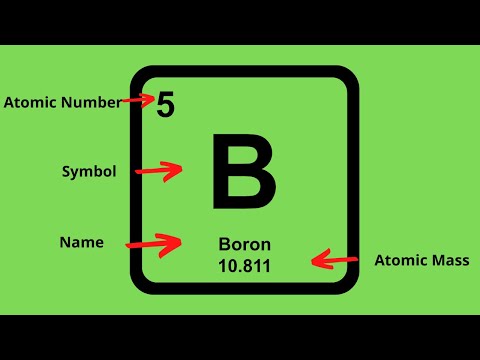
Het aantal elektronen in de buitenste schil van een atoom, ook wel de valentieschil genoemd, kan worden bepaald aan de hand van het atoomnummer van het element. Het atoomnummer geeft het aantal protonen en elektronen in een atoom aan.
Als je kijkt naar het periodiek systeem der elementen, kun je zien dat het atoomnummer bovenaan elk element staat. Bijvoorbeeld, zuurstof heeft een atoomnummer van 8. Dit betekent dat zuurstof 8 elektronen heeft, waarvan er 2 in de 1s-schil zitten, 2 in de 2s-schil en 4 in de 2p-schil. Aangezien de buitenste schil de 2p-schil is, heeft zuurstof 6 elektronen in zijn valentieschil.
Hoe bepaal je het aantal valentie-elektronen van een atoom?
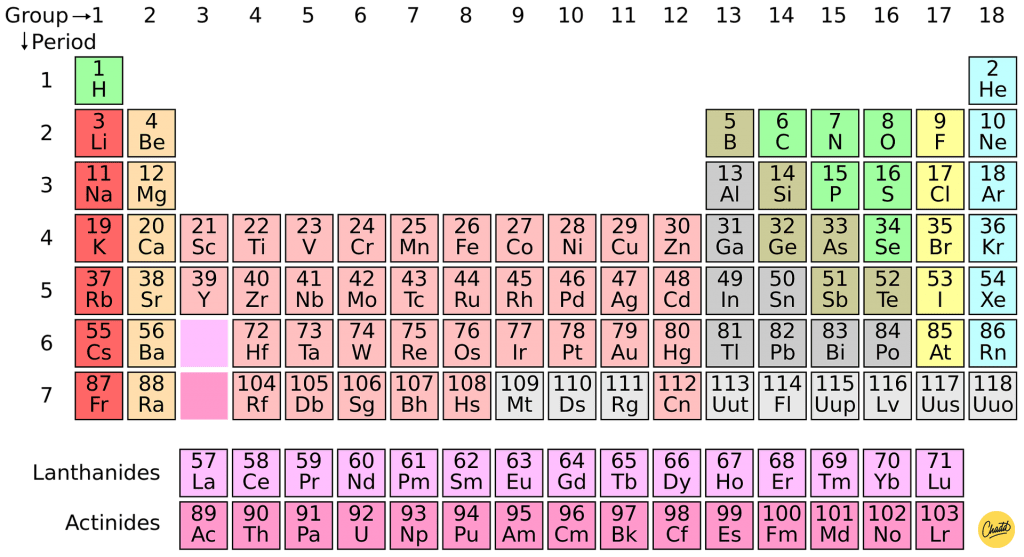
Het aantal valentie-elektronen van een atoom kan worden bepaald aan de hand van het groepsnummer van het element in het periodiek systeem.
In het periodiek systeem is elk element ingedeeld in groepen, die verticaal worden weergegeven. Het groepsnummer geeft aan hoeveel elektronen er zich in de buitenste schil bevinden. Bijvoorbeeld, elementen in groep 1 hebben 1 valentie-elektron, elementen in groep 2 hebben 2 valentie-elektronen, enzovoort.
Er zijn echter uitzonderingen op deze regel, vooral voor overgangsmetalen. Deze elementen hebben complexere elektronenconfiguraties en de valentieschil kan variëren.
Wat is de relatie tussen het atoomnummer en het aantal elektronen in een atoom?
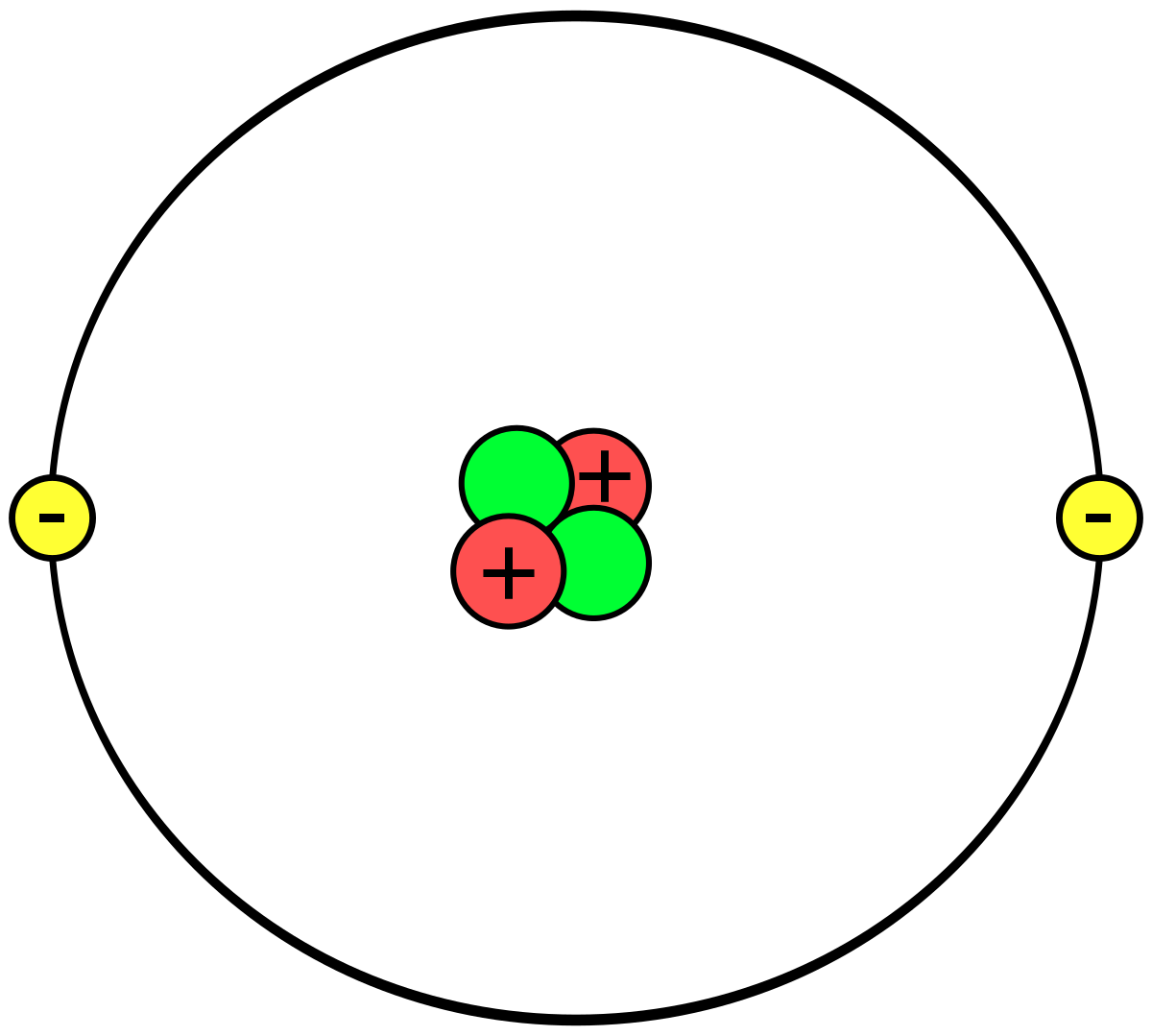
Het atoomnummer van een element geeft het aantal protonen en elektronen in een atoom aan. Aangezien atomen doorgaans neutraal zijn en geen lading hebben, zijn het aantal protonen en elektronen gelijk.
Bijvoorbeeld, koolstof heeft een atoomnummer van 6, wat betekent dat het 6 protonen en 6 elektronen bevat. Waterstof daarentegen heeft een atoomnummer van 1 en bevat 1 proton en 1 elektron.
Het atoomnummer geeft ook de identiteit van een element aan. Elk element heeft een uniek atoomnummer, wat betekent dat het aantal protonen in de atoomkern specifiek is voor dat element.
Hoe kun je het aantal elektronen in een atoom bepalen aan de hand van het periodiek systeem?
Het periodiek systeem der elementen is een handig hulpmiddel om het aantal elektronen in een atoom te bepalen. Het atoomnummer van een element, dat zich bovenaan elk element bevindt, geeft het aantal elektronen en protonen in een atoom aan.
Bijvoorbeeld, stel dat je het aantal elektronen in een zuurstofatoom wilt weten. Zoek eerst zuurstof in het periodiek systeem en kijk naar het atoomnummer, dat 8 is. Dit betekent dat een zuurstofatoom 8 elektronen heeft, verdeeld over verschillende schillen.
Daarnaast geeft het periodiek systeem ook informatie over de elektronenconfiguratie van elementen, waardoor je gedetailleerdere informatie kunt vinden over de verdeling van elektronen in verschillende schillen.
Hoe kunnen ionen en ladingen de elektronenconfiguratie van een atoom beïnvloeden?
Ionen en ladingen kunnen de elektronenconfiguratie van een atoom veranderen door elektronen te winnen of te verliezen. Een ion is een geladen deeltje dat ontstaat wanneer een atoom elektronen wint of verliest.
Wanneer een atoom elektronen verliest, krijgt het een positieve lading en wordt het een kation. Bijvoorbeeld, als een natriumatoom (Na) een elektron verliest, wordt het een natriumkation (Na+). Dit verandert de elektronenconfiguratie omdat er nu minder elektronen zijn om de schillen te vullen.
Aan de andere kant, wanneer een atoom elektronen wint, krijgt het een negatieve lading en wordt het een anion. Bijvoorbeeld, als een chlooratoom (Cl) een elektron wint, wordt het een chloride-anion (Cl-). Ook hier verandert de elektronenconfiguratie omdat er nu meer elektronen zijn om de schillen te vullen.
De verandering in lading en elektronenconfiguratie beïnvloedt de chemische eigenschappen van een atoom, zoals de neiging om bindingen te vormen met andere atomen.
Zijn er uitzonderingen op de elektronenconfiguratie regels?
Ja, er zijn uitzonderingen op de elektronenconfiguratie regels, met name voor de overgangsmetalen.
Een belangrijke uitzondering is chroom (Cr). Volgens de regel zou de elektronenconfiguratie van chroom moeten zijn 1s2 2s2 2p6 3s2 3p6 4s2 3d4. Echter, om meer stabiliteit te bereiken, gaat een elektron van de 4s-schil naar de 3d-schil, waardoor de elektronenconfiguratie verandert in 1s2 2s2 2p6 3s2 3p6 3d5 4s1.
Een andere uitzondering is koper (Cu). Volgens de regel zou de elektronenconfiguratie van koper moeten zijn 1s2 2s2 2p6 3s2 3p6 4s2 3d9. Echter, vergelijkbaar met chroom, gaat een elektron van de 4s-schil naar de 3d-schil, waardoor de elektronenconfiguratie verandert in 1s2 2s2 2p6 3s2 3p6 3d10 4s1.
Deze uitzonderingen worden veroorzaakt door de wens om een stabiele halfgevulde of volledig gevulde 3d-schil te bereiken.
Hoe kan het begrip elektronenconfiguratie worden toegepast om chemische reacties en bindingen te begrijpen?
Het begrip elektronenconfiguratie is van vitaal belang bij het begrijpen van chemische reacties en bindingen.
Chemische reacties treden op wanneer atomen elektronen winnen, verliezen of delen om een stabielere elektronenconfiguratie te bereiken. Als atomen elektronen delen, vormen ze covalente bindingen, waarbij ze elektronenparen delen om een volledige valentieschil te bereiken. Bijvoorbeeld, in een watermolecuul (H2O) delen twee waterstofatomen één paar elektronen met een zuurstofatoom om een stabiel molecuul te vormen.
Daarnaast kunnen atomen elektronen overdragen om ionische bindingen te vormen. Bijvoorbeeld, een natriumatoom (Na) kan een elektron verliezen om een positief geladen natriumkation (Na+) te vormen, terwijl een chlooratoom (Cl) een elektron kan winnen om een negatief geladen chloride-anion (Cl-) te vormen. Deze ionen trekken elkaar aan en vormen een ionrooster.
Het begrip elektronenconfiguratie helpt ons ook om de stabiliteit van atomen en moleculen te begrijpen. Atomen streven ernaar om een volledige valentieschil te hebben, wat meestal betekent dat ze 8 elektronen hebben. Dit streven naar stabiliteit verklaart waarom bepaalde elementen neiging hebben om elektronen te winnen of te verliezen om een stabielere configuratie te bereiken.
Al met al is het begrijpen van de elektronenconfiguratie essentieel voor het begrijpen van de chemie en het voorspellen van chemische reacties en bindingen. Door de verdeling en beweging van elektronen te begrijpen, kunnen we de eigenschappen en gedragingen van atomen en moleculen begrijpen.
Categories: Samenvatting 94 Hoe Weet Je Hoeveel Elektronen Een Atoom Heeft
Elk atoom heeft een atoom nummer. Met dit atoom nummer weet je ook direct het aantal protonen en elektronen, want het Atoomnummer = het aantal protonen = het aantal elektronen. Ook weet je van elk atoom het massa getal.Bij de elementen is in het atoom, het aantal elektronen gelijk aan het aantal protonen, waardoor de totale lading van het atoom neutraal is.In de Binas kun je rechts onderin bij de elementen zien hoeveel elektronen er in de schil zitten. Als voorbeeld bekijken we fosfor. In de Binas kun je zien dat de elektronenconfiguratie 2,8,5 is. In de buitenste schil zitten dus vijf elektronen, 8-5=3 dus er moeten nog drie elektronen bij om er acht te krijgen.
Hoeveel Elektronen Heeft Een Atoom?
Hoe Vind Je De Elektronen Van Een Element?
Hoe Weet Je Hoeveel Elektronen Een Ion Heeft?
Ontdekken 50 hoe weet je hoeveel elektronen een atoom heeft





See more here: c1.chewathai27.com
Learn more about the topic hoe weet je hoeveel elektronen een atoom heeft.
- Samenvatting Scheikunde Chemie overal Hoofdstuk 1 en 2
- Atomen en elementen – brouw-bier.nl
- Hoe werkt het periodiek systeem? – Mr. Chadd Academy
- Atomen en ionen – Nask:
- Atomen: Wat Zijn Dat? (Uitleg + Opbouw) – ExamenOverzicht
- Natuurkunde voor het MBO deel 3 ISBN 9789491764462, 1e druk …
See more: c1.chewathai27.com/category/herstelrubriek